
【摘要】
狂犬病病毒为弹状、单股负链RNA病毒,是人畜共患性狂犬病的致病源。这种属于弹状病毒科的狂犬病病毒属的病毒最早可能来源于非洲。几百万年来,不同的狂犬病病毒可能随着其最主要的宿主——蝙蝠的进化而进化。根据相对地域分布、多样性的研究,狂犬病病毒可能是狂犬病病毒属中最为常见的,但其具体原因则尚不清楚。所有的哺乳动物对狂犬病病毒都易感。除了蝙蝠以外,一些食肉动物也是狂犬病病毒主要的宿主,如犬科动物、浣熊、臭鼬、猫鼬和鼬獾等。作为一种以哺乳动物中枢系统为靶点的自然疫疾病,宿主的广度意味着难以消除这种疾病。尽管狂犬病的致死率是众多感染性疾病中最高的,但由于存在其他的人畜共患病,狂犬病并没有得到足够的重视。一旦发病,任何治疗措施都无法阻止死亡的到来。矛盾的是,早在一个世纪以前已开发出相应的疫苗,但绝大多数的患者都病没有接种疫苗。在发展中国家,狂犬病病毒感染犬科动物十分常见的地方,数以千万计的人易于与受感染的动物接触,而每年有数万个因此而死亡的病例,其中大多数为儿童。与其采取残杀动物的手段,对狗进行大规模的疫苗接种是减少人类感染更具有成本效益的策略之一。迄今为止,相关研究以获得了不少进展。在将来还需要继续努力的方面:包括发展一个更为统一的病毒分类方法;加强以实验室为单位的分散式监控;关键病原体的发现和鉴别;将病原生物学研究用于实际治疗;完善对狗患病风险的评估;疫苗和相关生物制品实际生产;最大程度控制人群感染率的同时对于不必要人群则不进行预防处理;以及可在全球范围内制定对疾病控制、预防和消除的长期的、实际的计划。
【前言】
狂犬病并不是一个年代久远的传说、一个恶魔般的神话或文学寓言,而是一种严重的病毒性脑炎,其致死率在所有传统的传染病中是最高的。今天,除了受感染的或受影响的人以外,谁还应该关注狂犬病呢?根据职业或业余爱好列举几例,如真正的动物爱好者、人类学家、政府管理者、洞穴探险者、环保爱好者、农民、医学专业人士、旅行家、卫生经济学家、远足爱好者、历史学家、人文学家、实业家、立法人员、建模人员、慈善家、社会学家、学生、动物保护学家以及生命科学家等等。这一部分人群有的为提升自我和态势感知能力感到好奇,有的关心公共利益,有的沉迷于应用微生物学和生态学的角度看待生命,有的乐于接受用专业的手段对自然进行干预的挑战。但有一个共同点是,他们都追求“非轻易达到的目标”。
狂犬病的感染周期通常是通过直接咬伤而在个体与个体间达到种内或种间传播,并不是从环境中获得感染,患病动物的唾液中含有大量的这种高度嗜神经病毒,在被咬部位进入被咬者的外周神经系统,潜伏期为数天至数周。病毒在体内从局部沿周围神经的轴索浆向心性扩散,随后侵入中枢神经系统(centralnervous system,CNS)的神经元。此后,病毒自中枢神经系统向多个受神经支配的位点离心性扩散,其中就包括唾液腺。病毒颗粒可随哺乳动物的日常接触行为传播,如口腔、粘膜或经皮传播。这些常规的方式可能传播效果不佳,异常行为的出现为二次接触提供了多种选择,其中涉及的范围从狂躁症到麻痹、瘫痪,通过有意地接触或被咬、增加到户外活动的机会、或因捕食携带有病毒的感染宿主的组织或器官而引起突然死亡。如果能引起有效的感染,病毒的繁殖周期能在感染后重新开始,能在出现排毒现象或明显的临床表现前潜伏数天、数周、数月,甚至数年(极少数)。这种必须寄生的特性能确保病毒能从感染者处传染给正常者。由于种属差异较大,这种病毒并不能感染无脊椎动物和植物,而恒温脊椎动物是狂犬病病毒的主要宿主。虽然这些物种的历史比人类更悠久,但他们目前的分布、分度和多样性已超过史前时期,尤其是人类纪。
在所有的恒温脊椎动物中,鸟类易被狂犬病病毒感染(鸟类不传播狂犬病),但最主要的感染宿主是各种哺乳动物。根据统计,所有的哺乳动物都可被感染,在字母表中从“a”开头的犰狳(armadillo)到“z”开头的斑马(zebra)都可作病毒的宿主。狂犬病是家畜和野生哺乳动物均可感染的疾病,但其人畜共患病的特点才它长期以来臭名昭著的原因。很少有文明能幸运地不受狂犬病病毒的感染,因此病毒感染对千百年来的艺术、文学、文化习俗都产生了影响。保守估计,在一个读者细读这篇文章的时间里,将有超过1300个人会暴露于狂犬病病毒(rabies virus,RABV)中。每年成千上万的人死于狂犬病,其中大多数是儿童。他们大部分因为贫穷而得不到现代医疗治疗,因病死于农村的家中而未被报道。假如以伤残调整寿命年分数和健康经济学为基础的方法衡量,狂犬病将在十大被忽视的病毒性人畜共患病排行榜中榜上有名,那么,人们就会在这些病原体身上投入大致等同的慈善资金。很不幸的是,真实情况并非如此。举个例子,其他一些被忽视的病毒性疾病可能对人类的影响较小,但在受到国际上的资助后却得到更多的重视。不完全扎根于科学,一个更全面的跨学科的哲学思维可帮助我们更好地部分理解,为什么在需要和援助之间存在这种生物医学的差异,也提醒这个领域内的研究者,在这种矛盾的情况下,需靠自己的力量来解决这件让人沮丧的事情。
在21世纪,在以公众利益为目标的全球行动的实施下,人们应该如何应对狂犬病呢?在今天,管理、控制、预防、消除、灭绝等等这些词可以在讨论一种疾病时任意使用,但它们绝非同义词。由于宿主的广泛存在和多样性,狂犬病并不如天花、牛瘟般容易消除。然而,狂犬病与这两个已灭绝的病毒病原体有至少三个相似的属性:确定的诊断方法、安全且有效的疫苗和流行病学的理论知识。以上三点将便于我们应用实验室方法和获批的生物制品来健全预防和控制措施。有些矛盾的是,基于一个世纪以来的经验,现代狂犬病管理,在一个真正健康一体化的水平下,完成了其他类似的人畜共患病的方案未能实现的情况:人类通过避免明确的暴露并在暴露后寻求预防治疗达到不患病;通过大规模免疫接种消除原发性犬科和继发性感染;并且在景观尺度内通过口服疫苗接种明显地灭绝了病毒在野生食肉动物中传播。以这些显著的进展为基础,本综述目的是在基于作者部分意见的基础上,重新讨论当前与现代狂犬病病毒分类学、种族发生学、监控、预防、治疗、控制和消除等相关的问题和挑战。本文囊括了这个领域内一个多世纪以来的知识、技能,不是单独地对历史进行回顾,而是在同类综述的背景下重点关注近几年相关的文献[1-115]。我们希望在某种程度上教育、启蒙和吸引大家,在“相信科学”的基础上让更多人有意义地参与这些工作中。
一个不断变化的病毒分类学:名字到底隐藏了什么?
分类学,是对地球上生活于复杂环境中的实体进行客观的、系统的分类和命名的正式尝试,从植物、动物等领域逐渐延伸到微生物领域。RABV和一系列系统发生相关病毒(能导致以急性进行性脑脊髓炎为特征的狂犬病)均属于狂犬病病毒属,弹状病毒科,单股负链病毒目的单链、非分段、负链RNA 病毒。持续监测以及新一代测序技术的进步,使得弹状病毒科的分类学愈发精准复杂,同时也有更多的新病毒被鉴定[1]。新鉴别的狂犬病病毒属在该科中自成一个基因型,与其他弹状病毒并没有亲缘关系。
最近,病毒分类学的国际委员会(International Committeeon Taxonomyof Viruses,ICTV)部分采用了在其他分类学领域中存在的物种双名命名法。但是ICTV将这种命名方法反着使用,即属名跟在种名之后[2]。这个变化的客观理由有点难以理解,除非ICTV试图强调“真正的”病毒颗粒与病毒、病毒物种的概念是完全不同的实体的事实。虽然病毒颗粒可以通过电子显微镜观察,事实上我们并不能看见一个“病毒”。病毒颗粒是粒子性的,而病毒是微生物种群的概念,病毒物种更是多集合的(或者说是一个捏造的“集装箱”),其中某些个体是基于其遗传、形态和生理化学特性而被人为放置的[3]。在生物学的其他领域,人们会使用科学名称称呼一个生物体,作为其物种的同义词。但这种方法在病毒分类学中则不适合。比如说,RABV属于狂犬病病毒属中的一个物种,被称为狂犬病病毒属。所以说,一般的病毒作为一个生物体,我们使用的名字通常为前者,而在考虑到分类学时则用后者。使用时如考虑其遗传背景就有点困难,例如RABV是一种病毒,但是Rabieslyssavirus(狂犬病病毒属)则是一个物种;Mokolavirus(莫科拉病毒)是一种病毒,但Mokolalyssavirus(莫科拉狂犬病病毒属)是一个物种等等。此外,还应注意到病毒名称可以缩写,而物种名称则不可以,这在今后几年可能会导致这个双名命名法的进一步变化[4]。
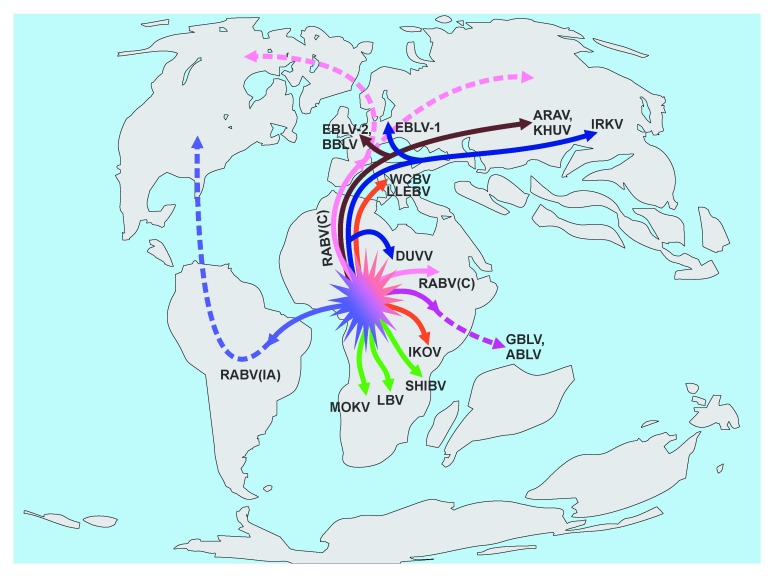
同属中的其他物种包括Aravanlyssavirus、Australianbat lyssavirus、Bokeloh lyssavirus、Duvenhagelyssavirus、Europeanbat lyssaviruses(1型和2型)、Ikomalyssavirus、Irkutlyssavirus、Khujandlyssavirus、Lagos bat lyssavirus、Mokolalyssavirus、Shimoni bat lyssavirus和West Caucasian bat lyssavirus[2]。另外两个被认为是狂犬病病毒的病毒尚未被纳入分类学中,一是此前通过部分基因序列鉴定得到,但尚未分离得到的Lleida bat lyssavirus(LLEBV)[5];二是不久前才提交到ICTV且最近被广泛提及的Gannoruwa bat lyssavirus[6]。狂犬病病毒属的亲缘关系如图1(分支的颜色与图2相同)。
在全球范围内,狂犬病病毒属可分为两个谱系,分类的依据是G蛋白胞外区以及血清学交叉活性的遗传差异[7]。谱系Ⅰ包括狂犬病病毒、欧洲蝙蝠狂犬病病毒1型和2型、Duvenhage病毒、澳大利亚蝙蝠狂犬病病毒、Aravan病毒、Khujand病毒、Irkut病毒、Khujand病毒和Gannoruwa蝙蝠狂犬病病毒。谱系Ⅱ包括Lagos蝙蝠病毒、Mokola病毒和Shimoni蝙蝠病毒。剩余的West Caucasian 蝙蝠病毒、Ikoma病毒和Lleidabat病毒则不属于任意一个谱系。虽然从系统发育上而言他们是相近的,但在目前的判断标准下,遗传距离和交叉中和表位的缺失使得它们并不能被归类于某个单一的谱系中[8]。狂犬病病毒属中不同种的病毒差异较其他弹状病毒属小。因此,其他特征如与单克隆抗体有关的抗原表位,以及生理特性(包括分布及宿主范围)等都无法很好地对病毒物种进行划分[9]。以上这种划分是基于一个在分类学上享负盛名的专家的意见。随着ICTV针对基于遗传距离而对病毒分类进行统一的争议越来越多,在不久的将来可能会尝试重新分类,其中会把谱系I的病毒和谱系II的病毒分成两个物种。当然,这种再分类将会丢失目前用于物种划分的某些重要特征,同时可能在某些区域产生社会经济或生物政治的后果。例如,在病毒分类学重新分类的基础上,如澳大利亚和西欧等RABV不流行的地区(可能存在某些由蝙蝠携带的狂犬病病毒属)可能会失去他们自认为“无狂犬病”的情况,变成与非洲、亚洲和新世界相同的疾病状态,继而在公众健康、兽医行业和经济上产生混乱。“狂犬病”这个词,可以说比那个人们不太熟悉的“蝙蝠狂犬病病毒”似乎更具有分量和严重性。
关于狂犬病病毒属起源、产生、永存和灭绝的谜团?
所有谱系Ⅰ的狂犬病病毒属都能在蝙蝠中传播。其中只有RABV可以在食肉动物中传播。而在谱系Ⅱ中Lagos蝙蝠病毒(LBV)和Shimoni蝙蝠病毒可在蝙蝠中传播,而Mokola 病毒(MOKV)的宿主则尚不清楚[10]。MOKV曾在鼩类和一些受感染的猫和一只狗身上分离得到[11]。West Caucasian蝙蝠病毒(WCBV)在一只蝙蝠身上被分离,而LLEBV的遗传物质也是在一只蝙蝠身上被鉴定。Ikoma lyssavirus(IKOV)从一只非洲灵猫中分离,但这种病毒与WCBV和LLEBV的亲缘关系表明,它可能是来源于蝙蝠而后感染了灵猫[8]。,加强监测可能有助于解决这个问题。
对于狂犬病病毒属的进化史目前并不明确,最广为接受的是观点是病毒基因组强大的纯化选择和中性进化学说[12-14]。狂犬病病毒属基因组的交换率与来自于不同物种的病毒之间和不同病毒基因之间的交换率相似,大约为3.8×10-5~2.1×10-3/年[13,15,16]。在混合效应模型选择进化的前提下,有一些研究提出了偶发性多样化选择学说。然而,这些研究都未能确定在宿主变化过程中涉及替换的氨基酸位点,而这些替换使得病毒获得更强的适应性和有利突变,继而可以在新的宿主中繁殖,因此我们应该谨慎地解释这种现象[15,16]。这并不奇怪,因为只有目前已有的序列(样本来源于过去30~40年间已知宿主物种)可用于分析,而狂犬病病毒属物种形成的历史时长已有好几个数量级了。
现存的狂犬病病毒属似乎适应了目前的宿主。通过与几十年前南非的LBV样品基因序列比对发现,高达95%的基因是保守的[17]。另一个研究发现,在肯尼亚分离得到的一株LBV,其基因组与22年前在塞内加尔分离得到的LBV有99%的相似性[18]。最新的宿主变换可能有助于我们阐明狂犬病病毒属的进化机制,但这并不常见,因为溢出感染通常会导致感染者死亡[19]。根据对蝙蝠RABV感染食肉动物进行观察后总结经验得出,病毒G蛋白的S242可能对于蝙蝠而言很有必要,而在以食肉动物为宿主的RABV中该位点则通常为A或T[20]。但是,目前尚没有针对此假说进行进一步的研究。
根据氨基酸置换率(分子钟,molecular clocks),研究者尝试创造狂犬病病毒属自然历史发展的时间表时发现,狂犬病病毒属的最近公共祖先(the most recent common ancestor,MRCA)存在于7,000至11,000年前,RABV的MRCA则存在于900至1,500年前[12]。由此推测北美蝙蝠RABVs的MRCA大约存在于118~233[13]至220~750年间[16,21]。
另外,有研究用相同的方法研究了相似或稍大的数据库,得出的结论为蝙蝠RABVs的MRCA其中一个谱系存在于436~1,107[15]年或436~500年[22]。越来越多的证据表明,这个时间的估计是建立在目前限有的样本序列上的,并不能真实地反映纯化选择约束下病毒进化的情况[23]。例如,与以前的分子时钟估计相比,一种具有更高置换饱和度的新方法使冠状病毒的MRCA增加了几个数量级,并且所得到的时间尺度与冠状病毒宿主库的时间尺度相当[24]。通常而言,从一组序列中获得的进化速率表现为时间依赖性,并且由于瞬时突变尚未通过纯化选择而被去除,使得结果较大。因此,在长时间框架中估计的置换率将比在短时间内获得的置换率低。这种效应与纯化选择一样强,甚至更强,这便形成了病毒进化的过程[25-27]。换句话说,基于置换率的分子钟估计仅可用于样品所覆盖的时间跨度,而不能用于时间跨度更长的结论推断。
狂犬病病毒属目前的分布、多样性和区分,以及对病毒基因组保守性的经验观察都与推测的MRCA存在时间有巨大差异。如果有人认为发表的狂犬病病毒时间尺度估计值是不正确的,可通过分析有限的分离株找到其他证据提出其起源和长期进化的假说。所有狂犬病病毒属的多样性都以蝙蝠为宿主中表现出(除了MOKV和IKOV,因这两这个物种的宿主尚未确定),而食肉动物只能保持RABV几个谱系的长期存在。因此,人们普遍认为蝙蝠是狂犬病病毒属的主要进化宿主[8,12,28]。狂犬病病毒属中多个物种只能在旧大陆(美洲和澳洲属于所谓的“新大陆”,而亚洲和欧洲属于“旧大陆”。)蝙蝠中传播(RABV除外),而只有RABV能在新大陆蝙蝠中传播。此外,新大陆蝙蝠中存在的RABV谱系以及在臭鼬和浣熊(所谓的“美洲本土”RABV)中流传的几个谱系,与在旧大陆食肉动物中流传的RABV谱系以及可感染犬类的“全球性”的谱系并源,其中,可感染犬类的谱系被认为是随着人群迁移而传播至全球范围的根源[29]。然而,在与其他物种的狂犬病病毒属比较的时候,所有谱系的RABV都是同源的且彼此间序列较为一致[30]。由此证据推测,RABV的祖先(与其他物种的狂犬病病毒属截然不同)可在Gondwana(冈瓦纳古陆)上的早期蝙蝠中传播,因为蝙蝠很可能起源于非洲地区[31]。一种名字为Onychonycteris的蝙蝠生活于5250万年前,其形态与现存蝙蝠形态相似[32]。其他相关的物种可能存在于更早的时间。分子推断表明,现存蝙蝠的MRCA至少存在于8000万年前,可能起源于白垩纪[31,33]。这种来源于古老的翼手目动物的RABV可能揭示了独立进化的“美洲本土”病毒谱系存在的原因,以及美洲和旧大陆相关蝙蝠物种中RABV缺乏相似性的原因(如Myotis spp.和Eptesicus spp.)。南美洲与非洲在10000~8400万年前分裂,并由南大西洋分隔开。古老的蝙蝠在不久后可能通过岛屿间或直接洲际间的飞行从非洲到达南美洲[31]。或许,在那个时候,蝙蝠就已经携带有“美洲本土”RABV的祖先(如图2)。这种病毒很好地适应了新的蝙蝠宿主(某些氨基酸位点的置换(如G蛋白S242)),并扩大了宿主范围,如phyllostomatids在美洲进行了宿主变换,感染了其他蝙蝠以及臭鼬和浣熊。系统发育分析表明蝙蝠的快速多样化进化,和所有科一样,都在新世纪时代晚期之前进化[31],对于与其宿主共同演化的病毒也是如此。随后几百万年,以纯化选择的约束条件下的停滞和缓慢的遗传漂移为特征。或许,在旧大陆继续进化的RABV谱系并没有获得这样有利的置换,因此不能如美洲地区那般感染多个蝙蝠物种,而是转变为食肉动物,这是相对而言近期的事。当然,这个假说也不能解释旧大陆的蝙蝠不被RABV感染的原因。但鉴于旧大陆不太理想的监测水平,蝙蝠RABV很有可能存在而未被发现。考虑到过去的十年间,有四种新的狂犬病病毒属被发现(包括在监测水平较佳的西欧发现的Bokeloh bat lyssavirus)以及最近被发现的Gannoruwabat lyssavirus(只在2016年的斯里兰卡发现[6]),我们应该期待未来将会在旧大陆发现更多狂犬病病毒属。目前非RABV狂犬病病毒属与RABV相比,其地理分布和宿主范围有限,这可能是美洲非RABV狂犬病病毒属缺乏的部分原因。如果过去的这些特征是相似的,那么一旦非洲和南美洲越来越远,这种病毒可能不会蔓延到现在的美洲(图2)。
或许,我们可以推测,许多病毒(包括旧大陆的多种蝙蝠RABV和新大陆的非RABV狂犬病病毒属)在6500万年前白垩纪-古新世期间灭绝了。据估计,当时有75%的生物物种在地球上消失[34]。由于主要宿主的灭绝,病毒物种也随之而变。尽管迄今为止尚未发现狂犬病病毒属,古生物学领域的进展和对单股负链病毒目其他成员的应用仍然支持这些古代病毒时间尺度的论点,即这些病毒已存在超过数千万年,而且它们随着宿主共同进化[35]。
基于实验室监测系统的忽视
在应用同一个健康(One Health)的背景下,狂犬病诊断是应用于可疑动物的唯一常规程序,也能直接确定是否需要对处于危险中的人进行特定的挽救生命的医疗干预。(http://www.cdc.gov/rabies/pdf/rabiesdfaspv2.pdf)。实验室诊断对疑似病例的确诊至关重要,部分原因是为了证明在暴露的人或动物中的预防效果,客观地判断疾病预防计划的影响,并可作为一个国家消除了该疾病的佐证。
在50多年以前就有敏感、特异、经济且及时的诊断测试了,而关于狂犬病常规的分子学方法则有越来越多的争论[10,36,37]。然而,尽管每天都有很多的野生动物、家畜和人类感染狂犬病,却只有一小部分被诊断出来。由于缺乏相关资源的支持而没有诊断出病例,产生了忽视的情况,从而大大地限制了对疾病负担的真正了解。处于最高风险的人通常是最得不到保护的,例如穷人、失去公民权的人,以及一些非农社区(如自由放养的野生动物和流浪狗)。
患病儿童高烧和昏迷会与其他疾病(如疟疾)混淆导致的误诊[38]。相反,在某些情况下,由于患者并没有意识到暴露的发生,所以被动物咬伤的历史可能会被忽略,便不会对脑炎进行原始鉴别诊断[39]。暴露与疾病的关系可能被遗忘,而且病人也可能由于病毒的潜伏期较长(数周至数月,甚至数年)而不会将两者联系在一起[40]。此外,国家实验室可能位于城市的中央而远离病例多发的农村地区。
忽视的后果显而易见。例如,儿童与带病小狗接触后,由于没有被诊断而错过了预防的机会,最终儿童死亡[41]。如果捐献者没有接受狂犬病的诊断,那么来源于急性死亡者的器官就可能使受者感染狂犬病[42]。除了区域水平以外,在全球水平上,缺乏针对野生动物的监测工作将会错误判断一个无狂犬病地区和新兴地方性动物病地区之间的差异[43]。同样,感染狂犬病的狗从犬病区域的迁移将对其他已花费大量金钱和时间去消除了犬类RABV的地区造成威胁[44]。相关报告常见于各种文献、网上资源(如ProMED)以及每日新闻中(http://www.animals24-7.org/2014/06/08/dog-meattraffic-still-spreads-rabies-in-vietnam/)。
虽然我们非常希望在病原体发现过程中发现新的狂犬病病毒,基本的监测信息可用于预防和控制已知的RABV,且对于公共卫生、农业和保护生物学均有影响,但使用实用的诊断工具更为重要(表2)。
关于疾病预防的方面
我们常常忘记了,狂犬病是一个可以用疫苗预防的疾病。在约一个世纪以前就有可用于预防狂犬病的生物制品了[45]。对于兽医、实验室工作人员以及某些旅行者等高风险人群而言,用疫苗暴露前接种是一种非常有效的预防方法[46,47]。再暴露后进行及时、适当的暴露后预防(post-exposureprophylaxis,PEP)可提高生存率,而PEP包括伤口护理、注射狂犬病免疫球蛋白(rabies immuneglobulin,RIG)以及注射狂犬病疫苗[48]。然而,大多数高风险人群在暴露前并没有进行疫苗接种,同时大部分RABV暴露患者也没有得到足够的PEP。免疫接种咨询委员会/世界卫生组织(Advisory Committee on Immunization Practices/WorldHealth Organization,ACIP / WHO)的建议和现实之间的差异引发了人们对更新颖、更便宜的产品的强烈争论和转化研究;希望可简化接种程序并提高易用性[49-58]。急需解决的问题包括:PEP能否在不注射RIG的情况下保持安全性(毕竟超过90%的人并没有接种RIG)?异源的RIG(如马源RIG)是否和人源RIG一样安全和有效?如果是的,那如何提高生产率?RIG 的剂量是需保证在每千克国际单位重要,还是忽略绝对剂量而保证局部浸润比较重要?如果RIG不可获得,直接在暴露部位注射疫苗是否能提高生存率?PEP能否缩短至一周甚至更短的时间?将狂犬病暴露前疫苗接种纳入儿童疫苗接种计划是否有意义?全球疫苗免疫联盟(Global Alliance for Vaccines and Immunization,GAVI)何时会将人类狂犬病疫苗纳入其投资项目中?单克隆抗体能否帮助解决RIG有效性和分布的问题(替代性)?是否应该研发新的生物制品以提高对非谱系Ⅰ狂犬病病毒属的保护范围?是否需要新的佐剂或减毒RABV疫苗以减少使用RIG?与先天性免疫相关的基因(如干扰素)是否应该整合到重组RABV疫苗株的基因组中?虽然该领域将始终从相关进展中获益,但是人们往往更关注新生物制剂的学术研究而忽略了可用于预防狂犬病的现有产品和技术的转化研究(表3)。
新出现的争议:关于“不治之症”治疗的范例转换
在今天,狂犬病病例的诊断率也和过去一样低,在有统计学意义的水平上而言(>99.9%),被诊断为狂犬病就意味着死亡。目前,尚未治疗方法可用于临床症状出现后的病例。狂犬病患者对于临床医生而言是一个极大的困难,医生们几乎没有选择[59]。对于兽医而言,可以将染病动物施以安乐死。但是对于临床医生,只能将病人进行隔离,并提供缓和治疗。
另外,病人也可能被送回家等死。自从二十世纪七十年代以来,在动物狂犬病研究期间有极为罕见的、非致命的人类病例(大多数有疫苗接种史)和偶发的“幸存者”被报道,证明临床的狂犬病可能并不总是以死亡结束,提示我们需对病人施以积极的抗病毒治疗[60]。在2004年,在美国威斯康辛州的一名少年因在被蝙蝠咬后得到了及时的医疗处理(包括诱导昏迷和给予抗病毒药物),成为第一个未曾接受疫苗接种的幸存者[61]。在那之后的十年时间里,有少数接受了“密尔沃基疗法”(Milwaukeeprotocol)的患者幸存。(http://www.mcw.edu/Pediatrics/InfectiousDiseases/PatientCare/Rabies.htm)然而,行动的动机是可以理解的,这种行动是对治疗不治之症的同情和英勇的尝试。谁能在马尼拉狂犬病病房中面对患者而不感到悲伤呢?(http://www.aljazeera.com/programmes/lifelines/2013/09/rabies-lifelines-isolation-patient-2013923164345829402.html)谁能在听到狂犬病对一个家庭那令人心碎的影响后不感到悲伤呢?(https://www.youtube.com/watch?v=u8o1tOuyghk)谁能在看完记录片“The Girl Who Survived Rabies”后不为其动容呢?(https://www.youtube.com/watch?v=qdPuXHhEwDk)虽然关于治疗性昏迷的危险和密尔沃基疗法的优点已经出现了激烈的争论,但热度不减的讨论激起了这一领域对于狂犬病患者是否具有治疗可能性这一问题的重新思考[62]。Asklepios是科学家联盟中重新投入这个问题的科学家之一,他研究的重点在于:鉴定可抑制RABV复制的药物;对在RABV感染期间可减少有害宿主反应的分子进行测试;是否能通过改变血脑屏障通透性提高治疗的有效性,以及这种方法在体内是否可行。(http://asklepiosfp7.eu/)除了技术见解、所需的专业知识、相关费用和相关的道德伦理问题,还需要考虑后遗症的存在,以及长期、终生的康复和生活质量问题[63]。为了取得进展,无论是兽医领域还是人类医学领域,都需要在结合动物实验研究来源或人类病例等的狂犬病病理学研究的情况下,采取更全面的方法来治疗狂犬病[64]。由专家组成的最佳组合的进行临床护理;从其他RNA病毒研究中找到最佳的抗病毒药物;有针对性的免疫调节;治疗时间最佳;具有理想年龄、遗传背景好及临床分期参数好且运气极佳的自愈患者;以上种种为未来找到对狂犬病进行更规范性治疗提供可能性(表4)。
关注疫苗的需求,争取2030年消灭人类和犬类狂犬病
在二十世纪晚期至二十一世纪早期,多个组织提出消除人-犬传播的狂犬病的目标日期,其中包括WHO、泛美卫生组织(the Pan American Health Organization)以及其他一些国际或非洲、亚洲和拉丁美洲的非国际组织[65-68](http://www.paho.org/hq/index.php?option=com_content&view=article&id=11243:step-up-action-toward-rabieselimination&Itemid=1926&lang=en)。这些目标日期在2013年5月得到世界卫生组织大会的认可。
人类狂犬病消除计划的重点在于控制、预防,最终通过大规模的疫苗接种消除犬类的狂犬病。每年的疫苗接种项目,犬类覆盖率高达70%,最终将有效地控制疾病并进一步达到消除其在犬类和人类中传播的目的[10,68]。对犬类疫苗接种数量的估计需要国家、WHO区域的努力,这些努力对于最终目标的达成至关重要。可理解的是,人们对犬类狂犬病疫苗的生产和应用的关注并不如预防人类狂犬病生物制品那般,而人类狂犬病生物制品可用性仍有限制,尤其是在农村地区。据估计,今天,除了美国以外的其他犬类狂犬病流行的地区狗用疫苗覆盖率低于20%(表5)。
在犬类狂犬病流行的国家,其犬类疫苗的生产、运输技术、产品进口及使用等都有所限制。为了预防人类感染狂犬病,北半球的制造商和越来越多的来源于新兴市场(如中国、印度)的生产商每年生产大量的疫苗运输到狂犬病流行的地区(如非洲、亚洲和东地中海地区),用于高达2800万狂犬病病例的PEP中,拯救了98%的患者。不幸的是,由于狂犬病疫苗较以前更容易获得了,在非洲和亚洲一些城市的中心,疫苗滥用的情况愈发严重(即对非高风险人群进行PEP处理,其比例高达70%)。因此我们需要更多的宣传和教育工作,对公众和专业人员进行普及[70]。在欧洲和北美洲,疫苗滥用情况较少,因为这些地区由狗传播的人类狂犬病已经被消除。
在2012年,在多方捐助者的资助下,世界动物卫生组织(World Animal Health Organization,OIE)建立了犬类狂犬疫苗库,旨在协助亚洲国家开展(如阿富汗、老挝、缅甸)或加强(如菲律宾、斯里兰卡、越南)其免疫接种计划[71,72]。疫苗库所提供的疫苗很有效,但与十个亚洲受益国总共的国家计划中年需求量相比,其数量仍然有限(从2012年至2015年4月,大概有370万剂)。打个比方,三年来越南收到的疫苗共约100万剂,但每年需要接种的狗就接近1000万只。同样,WHO也表示希望建立人类狂犬病疫苗储存库,以便根据要求快速提供有质量保证的疫苗[73]。在全球范围内,人类狂犬病疫苗数量似乎接近足够,但在国家水平而言则并非如此,主要问题包括:评估不必要或不适当使用的PEP,尤其是城市中心地区;将“咬伤治疗中心”的专业人员分配到有需要的社区;提供免费或低成本的狂犬病生物制品;并为暴露的患者进行经济和易于实施的PEP处理[56]。
2015年,WHO召开了一个关于人类和犬类狂犬病疫苗和RIG的会议。会议上的议题包括未来的需求、疫苗和RIG质量控制、资金和采购问题,此外还在国家和区域水平上估计了中期和近期对人类和犬类疫苗的需求数量[74]。会议上,狂犬疫苗的生产商表明疫苗生产能力的不足并不会构成问题,如果有经济支持,预测疫苗的产量将有所增加。然而,就目前看来,主要生产商的年产量大概为一亿剂,最高年产量为1.5亿[75]。这样的生产量意味着,每年狂犬疫苗的生产主要满足了最有利益价值的北半球的需求(如美国、加拿大、西欧和东欧),这些地区有将近1.7亿宠物狗,而只有少部分用于非洲、亚洲、欧亚大陆以及中东地区的4.11亿宠物狗和流浪狗的接种(表5)。拉丁美洲的国家通过对犬类进行疫苗接种,该地区的人类狂犬病几乎被消除了,但对狂犬疫苗的年需求量约为4200万剂,其中大部分由墨西哥和巴西当地的生产商提供[76,77]。属于欧盟(EU)、东南亚(South-East-Asian,SEA)和世卫组织西太平洋(WesternPacific,WP)区域的中亚地区,其犬类狂犬病流行的国家使用狂犬疫苗剂量几乎占总数的74%。非洲和东地中海地区分别占剩余的15%和11%。
为了达到消除人类和犬类狂犬病的目的,世卫组织对非洲、亚洲、欧亚和东地中海区域的犬类狂犬病疫情国家中期(2015~2020年)和长期(2020~2029年)疫苗的需求量进行了估计。前提是这些疫苗必须符合所有的国际标准和规定[10,37,78]。在估算的时候,最敏感的数据之一按地理区域/世卫区域和中国、印度等大国,其人和犬的比例。在以前的文献中使用到的数据为每一人对应的狗的数量以及国家聚集情况[70,79]。一些有犬类狂犬病疫情的国家被列入现有的名单中。
当国家数据不可用时,可使用群集内各国的平均估计数。表6列出了在以前的工作的基础上,非洲、亚洲和东地中海地区超过85个狗狂犬病疫情国家的人口数和犬类数以及人均狗的数量比例[70,80,81]。
随着时间推移,使用上述人口估计来计算犬用疫苗需求,我们保守地使用了十年国家犬类狂犬病消除模型,分为5年的攻击期,3年的巩固期和2年的维持期。其中,随着阶段变化,疫苗接种覆盖率从70%下降到20%,最终达到5%。这个模型是基于理论和实际经验而得的[82-86]。另外,不同国家模型的分期不同。攻击期、巩固期和维持期的时间长短可以变化。在国家和主要国际组织的共同领导下进行持续十年的犬类狂犬病免疫接种活动十年,有可能在多个地区达到人类狂犬病病例降为零的目标[87]。
根据世卫组织各区域和时间段,对每个国家的犬类疫苗的需求量进行了汇总。世卫组织各区域和如中国、印度等大国的犬类疫苗估计需求量结果见表7。对于世卫组织欧洲(欧亚大陆)、东地中海地区、亚洲和西太平洋区域,攻击期为2015至2019年,而巩固期为2020至2022,维持期为2023至2024,因此消灭人类狂犬病的时间为2020年。以上提到的世卫组织区域中的许多国家,尤其是东南亚区域和西太平洋区域,这些地方(如菲律宾、斯里兰卡、泰国、越南、印度尼西亚部分地区以及印度和中国)人类狂犬病疫情严重,他们承诺在2020年达到消除人类狂犬病的目标,并已进一步开展他们对犬类和人类狂犬病的控制工作。对于非洲区域而言,攻击期为2020至2024,巩固期从2025年开始至2027年结束,维持期为2028至2029,消除人类狂犬病的目标计划于2030年达成。非洲区域,尤其是撒哈拉以南的非洲地区,由于富有犬类狂犬病免疫运动经验的国家数量相对较少,整个十年计划的实施和准备的时间都将使他们受益匪浅。
根据这些估计,在亚洲和中东的攻击期,即从2015年到2019年,需要将近13亿剂的疫苗(每年超过2.6亿剂,其中包括10%的浪费率)。这还只是一个保守的数字,因为这个数字将中国和印度城市中心约有十亿的人口和相关的犬类数量排除在外了。在印度,主要城市实施了特别的狂犬病控制计划[88]。在中国的大城市里犬类狂犬病的流行率较低,但犬只所有权法(尽管最近稍微放松,且较难以执行)仍然相当严格[89]。此外,从2020年到2024年,这些地区的巩固期需要5.6亿剂(约1.1亿剂/年),以在非洲启动和执行项目并维持此前已消除疾病的区域的安全性。这意味着在2015-2019年期间,每年向印度和中国农村提供五倍的狂犬疫苗,是欧亚大陆的三倍,是目前用于东地中海地区的两倍,更是2020至2024年间整个非洲需求量的五倍。鉴于其他现有优先市场的要求,短期(2015~2019年)所需的数量可能超过主要制造商增产的能力。另外,南亚、东南亚以及东亚的国家,尤其是中国和印度,对这些狂犬疫苗的需求量约占全部的五成,目前采用主要涉及北半球制造商生产单位的纯粹、有效、安全的疫苗采购机制难以被所有人接受。
为了实现到2030年消除人类狂犬病的目标,除了大规模的犬只疫苗接种之外,国际组织还必须支持RIG生产(尤其是在发展中国家),为新疫苗预认证开启“快速通道”,并投资生产新的、更安全、更经济的生物制剂,用于被动免疫[51,78,90]。
相关组织应协同国家公共卫生局一起,必须强烈劝阻大量非必要PEP的使用,将这些PEP用于真正需要狂犬病生物制剂的地区,以免造成资源的短缺和浪费(表8)。
关于犬类狂犬病疫苗,他们的持续使用一再被证明对于启动犬类狂犬病控制活动而言是至关重要的[85]。为了在2030年达到消除狂犬病的目标,国际组织和疫苗生产商必须认真考虑到可有效提高兽用狂犬病疫苗生产率的关键步骤。这些步骤包括加速向非洲和亚洲进行技术转移,并将一些现有的人狂犬病疫苗生产力转向犬狂犬病疫苗的生产,如30多年前由Rockefeller和世卫组织联合倡议的[91]。同样,GAVI对人类狂犬病疫苗的支持可能允许符合条件的政府开始使用任何保护资源以针对动物公共卫生,如在20世纪80年代在美洲区域实施的手段那般。即使是在受影响情况最严重的地区,对于犬类疫苗接种计划的相对适度投资预计会对人类狂犬病疫情产生重大的成本效益结果[92]。
未来展望
病毒分类法可能会继续主观地适应不断变化的时代要求、哲学观念以及生物政治压力,但无论患有这种疾病的具体病因是什么,狂犬病的名字仍然不变。狂犬病病毒属与宿主共同进化的理论将由方法学改进和更多病原体的发现来补充。通过增强的、分散的实验室监测和重点检测工作,预计可能会发现其他的病毒物种和新的寄主。疫苗和RIG的储存,重视现有的建议以及完善风险评估将增加暴露前疫苗接种量,最大限度地对真正暴露了的患者使用合适的生物制剂,并减少PEP失败的可能性。基于狂犬病致病机制的日益完善,突出强化处理脑炎的临床技能以及生物制剂和抗病毒药物协同作用将增大狂犬病患者及患病动物的治愈率,同时兼顾疾病的预防工作。理想情况下,在渐进的全球商业计划下,即最低限度地将估算的生物制剂用于危险人群且得到赞助者的赞助,拉丁美洲将在五年内消除犬类介导的狂犬病,而亚洲需要十年,非洲则预计目标达成于2030年。尽管根除不是目的,但鉴于野生动物库的多样化以及缺乏破坏翼手目之间长期生物链的战略,早就应该完成应对一个古老而阴险但被忽视的“杀手”如此雄心勃勃的目标了。

(麦健仪翻译 孟胜利校对)
| 欢迎光临 中国病毒学论坛|我们一直在坚持! (http://bbs.virology.com.cn/) | Powered by Discuz! X3.2 |